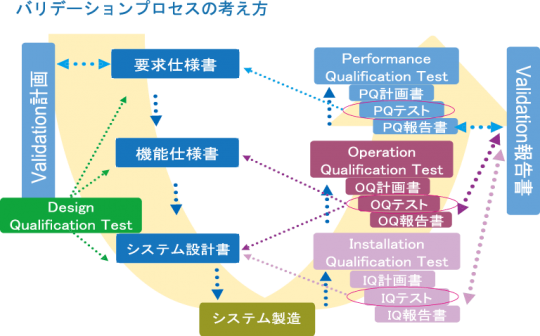
システムバリデーション
医薬品の開発プロセスにおいて利用されるコンピュータシステムは、医薬品開発に対する各段階の規制要件等に準拠し、恒常的に高い品質を確保するために、コンピュータシステムバリデーションを実施することが義務付けられています。
- 1997年:米国FDAが制定した医薬品の開発・製造における電子記録・電子署名に関する規制 「21 CFR Part11」
- 2005年4月:厚生労働省(MHLW)が制定した「医薬品等の承認又は許可等に係る申請等に関する電磁的記録・電子署名利用のための指針」 (ER/ES)
上記規制に基づくコンピュータシステムバリデーションや電磁的記録・電子署名利用に関する製薬企業への要求を実現すべく以下の支援を提供します。
- IT強化のための課題調査・分析および改善のための提言
- ビジネスプロセスのIT化に向けての準備
- コンプライアンス向上のためのIT関連規定の策定支援および運用支援
- リスク管理支援、ビジネス継続性の維持、管理支援
- 新規システムの検討、導入提案
- 既存システムの改善提案
- コンピュータバリデーションプロセスの標準化(基準、標準、手順)
- GLP、GCP、21 CFR Part11等遵守のシステム構築
- スタッフの教育・研修
- その他の依頼事項に対する質疑応答、調査